Aquí hemos reunido algunas de las preguntas más comunes sobre la nueva pandemia de coronavirus. Esta sección se centra en la vigilancia genómica, pero también se tratan otros temas importantes que pueden preocupar al público. El contenido de esta página está en constante revisión y con el tiempo se añadirán nuevas preguntas y respuestas.
PREGUNTAS FRECUENTES
La Red de Genómica de Fiocruz es un conjunto de grupos de investigación de varias unidades de la Fundación Oswaldo Cruz presentes en todas las regiones de Brasil, que trabajan coordinadamente para estudiar la genética y la genómica de microorganismos relevantes para la salud humana.
La Red ha estado trabajando en la secuenciación y el estudio del genoma del SARS-CoV-2, coronavirus causante de la COVID-19, como parte del esfuerzo global para vigilar la dispersión del virus en diferentes regiones del mundo, centrándose en la identificación y el seguimiento de sus mutaciones genéticas y la aparición de nuevos linajes. Para más información sobre la Red y sus instituciones asociadas, acceda a la página “La Red” de nuestro sitio web.
La secuenciación genómica de alto rendimiento realizada en muestras del nuevo coronavirus (SARS-CoV-2), además de permitir el seguimiento de la circulación de los diferentes linajes del virus, la detección de patrones en la aparición de nuevas variantes y su propagación en relación con otros linajes y la identificación de variantes aún no descritas, también permite el estudio de mutaciones relevantes del virus.
Entender cómo se propaga el virus Covid-19 entre las distintas regiones y controlar la prevalencia de sus diferentes linajes genéticos es un proceso de gran relevancia para la planificación estratégica de la lucha contra la pandemia. Estos datos son de gran importancia para el desarrollo de pruebas de diagnóstico específicas para las nuevas variantes, la actualización de las vacunas y el diseño de medidas de salud pública para contener la enfermedad.
El estudio de alteraciones genéticas como las de la estructura de la proteína Spike -a través de la cual el virus entra en las células del huésped- también es importante para comprender los riesgos asociados a la circulación de estas variantes mutantes. Este conocimiento permite identificar las mutaciones que pueden servir de “señales de alerta”, al aparecer de forma independiente en lugares distintos, como los de las posiciones E484 y N501 de la proteína Spike.
La Red de Genómica es el resultado del trabajo coordinado de los laboratorios y grupos de investigación de 12 unidades de Fiocruz, que ya realizaban estudios tradicionales con la genómica de varios organismos de interés para la salud humana antes de la pandemia del Covid-19. Así, la secuenciación y el análisis del material genético de organismos causantes de enfermedades como la Leishmania, de virus respiratorios como la gripe y el virus respiratorio sincitial, y de otras enfermedades como el dengue, el sarampión y la esquistosomiasis ya formaban parte de la rutina de los laboratorios que integran la red antes de la actual emergencia de salud pública.
En el ámbito del estudio del SARS-CoV-2, la Red Genómica estudia las secuencias genéticas de las muestras de coronavirus recogidas en todo Brasil, alimentando la base de datos de la iniciativa internacional GISAID e identificando los linajes variantes del virus que circulan en las diferentes regiones del país.
Los grupos de investigación que componen la Red de Genómica llevan años trabajando en el estudio de los más diversos aspectos del genoma de los organismos causantes de enfermedades infecciosas. Gracias a las investigaciones de los laboratorios que ahora forman parte de la red, entendemos mejor los mecanismos de patogénesis -es decir, los mecanismos a través de los cuales un organismo o virus provoca un cuadro clínico-, la propagación, la evolución y el genoma de los agentes causantes de enfermedades relevantes para la población brasileña.
Entre ellos se incluyen estudios centrados en arbovirosis como el dengue y el zika, así como en parasitosis tropicales como la leishmaniosis y la enfermedad de Chagas. La cartografía de los lugares donde se producen estas enfermedades, junto con el análisis genómico de las muestras de cada localidad, ayuda a detectar las zonas de mayor riesgo, a formular estrategias de control y prevención y a comprender la evolución de los agentes causantes. El estudio del genoma de estos patógenos también es importante para conocer con más detalle los mecanismos de cada enfermedad, lo que abre las puertas al desarrollo de enfoques terapéuticos y/o profilácticos (como las vacunas) para combatirlas y devolver la salud a los pacientes afectados y sus familias.
Desde 2020, con la formalización de la Red de Genómica, esta investigación se centra en el nuevo coronavirus SARS-CoV-2, y en la comprensión de múltiples aspectos de la actual pandemia causada por este nuevo patógeno.
La secuenciación del genoma es una técnica basada en las reacciones químicas que ya se producen de forma natural en las células cuando se replica el material genético. Asociando las enzimas utilizadas en esta duplicación con una tecnología de fluorescencia, las técnicas de secuenciación permiten conocer parte o la totalidad de la información presente en el código genético de un organismo. Así, permite identificar los genes, predecir sus productos (proteínas, RNA de interferencia, ribozimas, etc.) y comparar las secuencias de diferentes organismos.
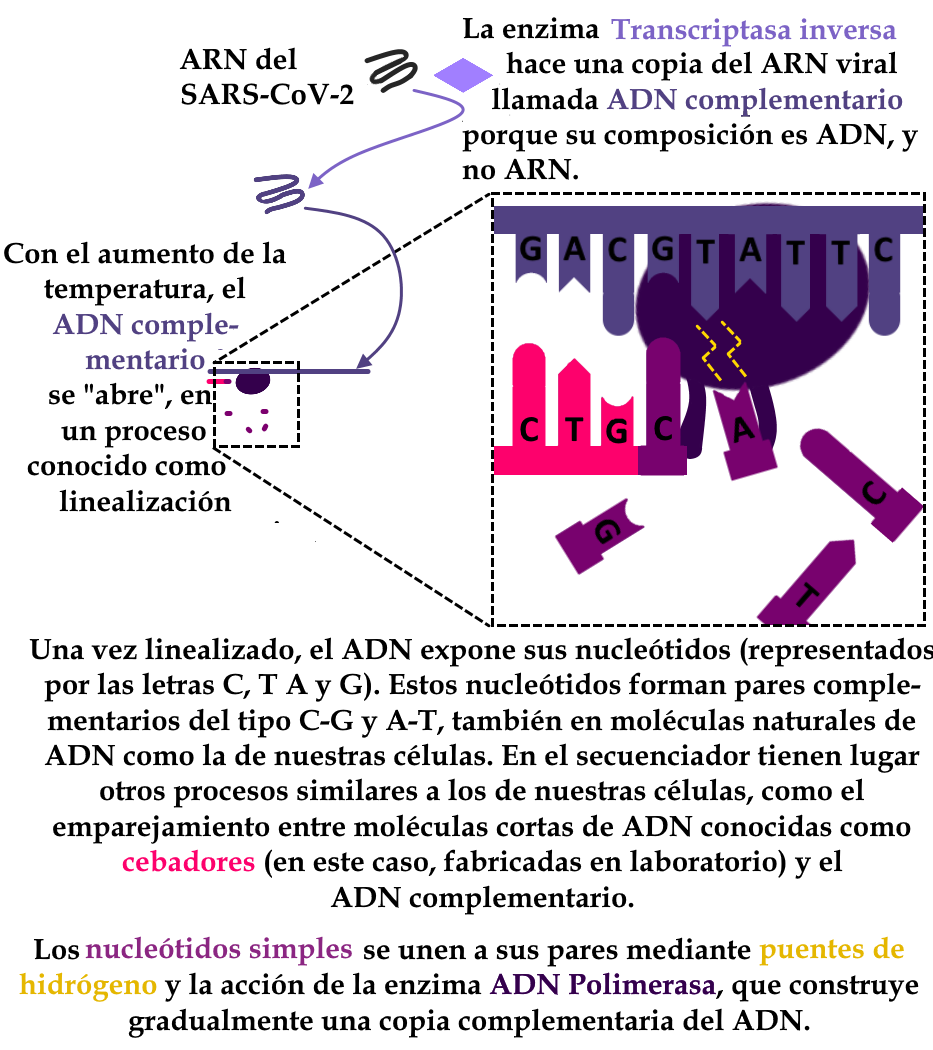
A partir de esta comparación, entre las secuencias de muestras más antiguas de SARS-CoV-2 y las secuencias de muestras más recientes, es posible identificar los puntos en común y los puntos de divergencia entre sus genomas. Este análisis permite trazar líneas evolutivas y analizar el parentesco entre variantes. De este modo, las muestras de virus que tienen el mismo origen, y se diferencian del mismo ancestro, se clasifican en el mismo linaje, y también es posible entender cómo un linaje da origen a otros.

En cualquier evento epidémico a gran escala, especialmente aquellos caracterizados por una rápida propagación del agente etiológico, el seguimiento de casos es importante para seguir la dinámica de la epidemia. El perfil genético del virus proporciona información sobre su propagación desde un punto de vista geográfico y temporal, revelando sus principales vías de transmisión. En otras palabras, el genoma es la identidad del patógeno y revela dónde y cuándo se propagó.
Un año después de la aparición del Sars CoV-2, la secuenciación genética adquiere un papel aún más central en la lucha contra la pandemia debido a la aparición constante de nuevas variantes del virus. Estas se clasifican como “variantes de interés” (aquellas que deben monitorearse de cerca, pero es menos probable que se asocien con casos más graves o una mayor infectividad) y “variantes de preocupación” (aquellas que probablemente tengan implicaciones sustanciales para la salud pública). ). El estudio de las mutaciones también permite comprender mejor los mecanismos de patogenicidad, es decir, los genes asociados a la aparición de la enfermedad, su gravedad o su capacidad para infectar a nuevos huéspedes.
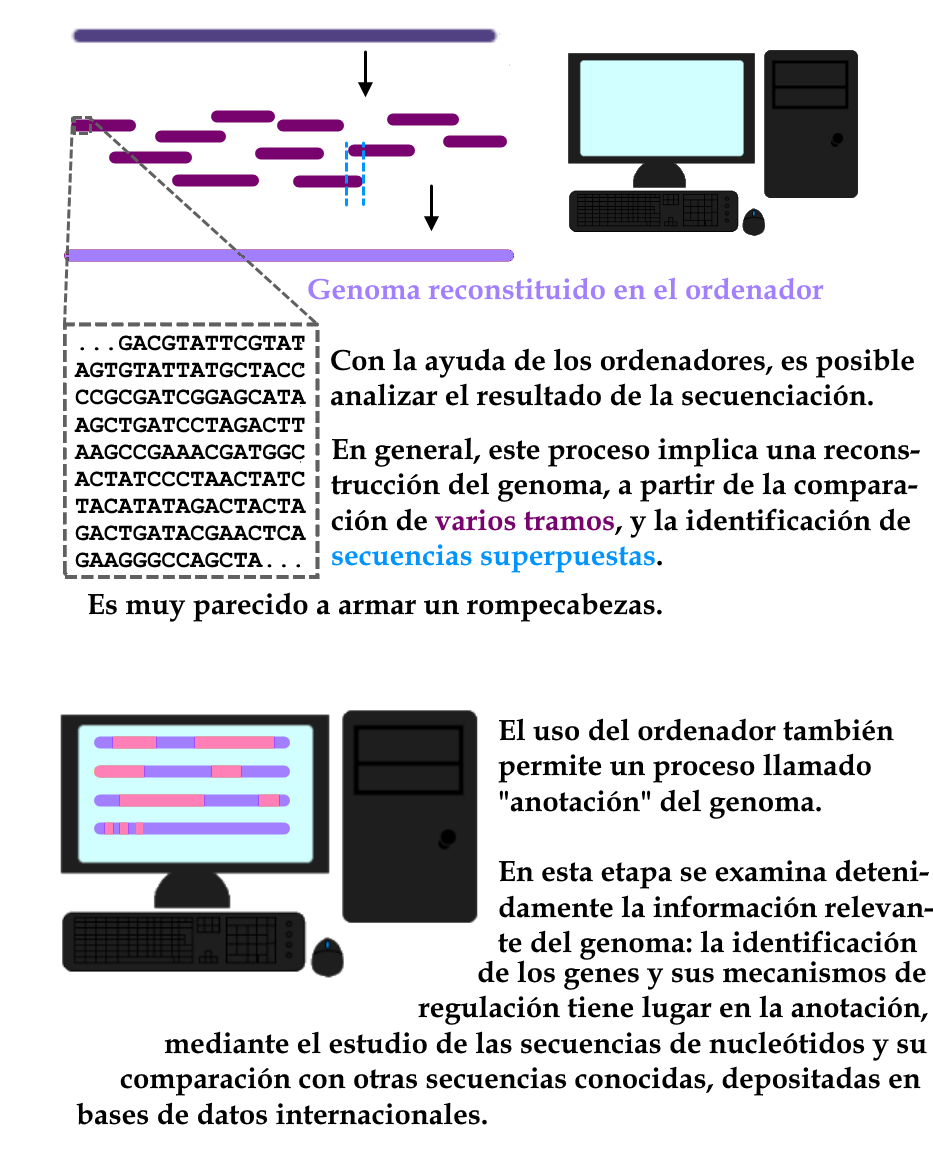
La anotación de genomas consiste en el análisis de los datos generados tras la secuenciación, es decir, el estudio detallado de las secuencias de información genética, con ayuda del ordenador. El proceso de anotación implica la identificación de estructuras que marcan regiones del genoma, como el inicio y el final de los genes, las secuencias que intervienen en la regulación de la expresión (activación o desactivación) de los genes y, eventualmente, las regiones que no se expresan. La anotación es, por tanto, la interpretación y organización de la información genética. Puede ayudar, por ejemplo, a comparar diferentes versiones de un mismo gen, presentes en muestras de diferentes linajes, y entender cuáles son los cambios en estos genes (y en las secuencias cercanas, que pueden influir en su expresión). De este modo, al desentrañar el significado de las secuencias, la anotación es un paso indispensable en el estudio del genoma del nuevo coronavirus, y en la clasificación de las muestras en linajes.
El seguimiento de la propagación de las nuevas variantes permite evaluar el riesgo de cada una de ellas con respecto a la propagación durante una pandemia. Combinado con el seguimiento de la tasa de aislamiento social y de las situaciones que favorecen la relajación de los cuidados (por ejemplo, la reapertura de algunos sectores económicos, las vacaciones largas, las fechas conmemorativas y los acontecimientos políticos), el seguimiento de las variantes permite identificar los acontecimientos clave de su propagación, lo que permite comprender cómo una variante llega a una nueva localización. Este trabajo también ayuda a evaluar la eficacia de las estrategias de lucha contra la epidemia y puede servir de base para las campañas de concienciación sobre las mejores medidas que deben adoptarse para contener la propagación de la enfermedad.
Conocer el genoma de un agente infeccioso -ya sea un virus, una bacteria, un hongo o un parásito- permite adoptar una serie de enfoques para combatir la enfermedad que provoca. En cuanto al desarrollo de tratamientos, el análisis de las secuencias genéticas aporta información sobre la fisiopatología del virus, identificando posibles dianas para la intervención terapéutica.
Además, el estudio de los genes implicados en la patogénesis puede ayudar al desarrollo de nuevas terapias a través de otro enfoque: el modelado molecular tridimensional. Gracias a las herramientas bioinformáticas, es posible construir modelos de proteínas importantes, como la Spike del nuevo coronavirus, que participan en la invasión de las células hospedadoras. A partir del estudio de las secuencias genéticas responsables de la expresión de esta proteína, es posible no solo predecir su estructura y desarrollar moléculas que bloqueen su unión a los receptores presentes en las células humanas, sino también comprender cómo las variantes de estos genes -fruto de mutaciones presentes en distintos linajes- influyen en la forma de las proteínas. Este enfoque permite comprender la importancia de ciertas mutaciones para la capacidad del virus de causar la enfermedad.
El nuevo coronavirus, denominado SARS-CoV-2, es un virus de ARN (un parásito intracelular que depende de un huésped para su viabilidad y replicación) que surgió en poblaciones de especies de murciélagos asiáticos y posteriormente desarrolló la capacidad de infectar y propagarse en poblaciones humanas. La enfermedad causada por el SARS-CoV-2 se denomina COVID-19 (en referencia al año en que comenzó la actual pandemia), y puede afectar a personas de todas las edades, tendiendo a causar casos más graves en los adultos mayores y en los pacientes con comorbilidades como la hipertensión, la diabetes, el corazón y el sistema inmunitario y respiratorio. Según el sitio web de los Centros de Control de Enfermedades de Estados Unidos, los principales síntomas del nuevo coronavirus son:
- Fiebre y/o escalofríos;
- Tos;
- Dificultad para respirar y/o falta de aliento;
- Fatiga;
- Dolores musculares o corporales;
- Dolor de cabeza;
- Pérdida reciente de los sentidos del olfato y/o del gusto;
- Dolor de garganta;
- Secreción nasal y/o goteo nasal;
- Náuseas o vómitos;
- Diarrea;
El sitio web también indica que pueden aparecer otros síntomas, además de indicar que se busquen servicios sanitarios de urgencia cuando se encuentren los siguientes síntomas:
- Dificultad respiratoria más severa;
- Dolor y/o presión persistente en el pecho;
- Confusión mental;
- Incapacidad para despertarse o mantenerse despierto;
- Piel, labios o placa ungueal (piel bajo las uñas) pálidos, grisáceos o azulados según el color de la piel;
Los síntomas anteriores pueden estar relacionados con el desarrollo de una condición respiratoria conocida como Síndrome Respiratorio Agudo Severo, que puede ocurrir en enfermedades pulmonares y está altamente asociado al SARS-CoV-2. El nuevo coronavirus también puede promover cuadros severos con hiperinflamación de tejidos, incluyendo el pulmón, además de la invasión de tejidos externos al sistema respiratorio (como el Sistema Nervioso Central y los vasos sanguíneos), dando lugar a otros cuadros de salud, como la encefalitis.
Es importante destacar que el COVID-19 puede presentarse sin manifestación de síntomas, o solo con síntomas leves, que a menudo se confunden con resfriados y gripes, por lo que una persona aparentemente sana o con pocas molestias puede contaminar a quienes la rodean. Por lo tanto, la adopción de prácticas como las que se describen a continuación en “¿Cómo prevenir la infección y la propagación del nuevo coronavirus?” es necesaria incluso en ausencia de síntomas más graves.
Las mejores formas de prevenir la propagación del nuevo coronavirus son:
- La adopción del distanciamiento social con medidas de restricción de la circulación de las personas, como horarios especiales para la actividad de sectores específicos de la economía y la reducción o restricción total de las actividades no esenciales – el llamado lockdown, que consiste en la paralización completa de las actividades no esenciales.
- Utilización de mascarillas, preferentemente del tipo PFF2 o N95, que tienen una filtración equivalente. Si no hay posibilidad de adquirir máscaras de este tipo (o similares de la misma clase de protección), se pueden utilizar máscaras de tela con dos o tres capas, aunque no ofrecen una protección similar a las máscaras PFF2. Las mascarillas deben utilizarse correctamente, cubriendo toda la nariz y la boca, para que puedan cumplir su función de reducir la cantidad de partículas víricas que se escapan en gotas de saliva. Las mascarillas PFF2/N95 pueden reutilizarse, con la precaución de dejarlas intactas en un lugar ventilado durante al menos 3-7 días entre un uso y otro. Las mascarillas de tela, por el contrario, deben lavarse a fondo con agua y jabón y aclararse y secarse entre usos.
- Lavarse las manos, cubrirse las vías respiratorias con los codos o los hombros al toser y estornudar, y tener cuidado de no tocarse los ojos, la nariz o la boca con las manos sucias también reducen la posibilidad de contraer la enfermedad. Cuando no sea posible lavarse las manos con agua y jabón, utilice alcohol en gel o alcohol líquido.
Aunque todas las personas corren el riesgo de contraer la enfermedad, hay sectores de la población que, debido a condiciones de salud anteriores, tienen un mayor riesgo de desarrollar cuadros graves, con necesidad de hospitalización, ventilación mecánica y mayor riesgo de muerte. El sitio web de los Centros de Control de Enfermedades de EE.UU. enumera los siguientes grupos/condiciones de salud:
- Personas de edad avanzada;
- Las personas que viven en la pobreza, debido a la mayor aparición de comorbilidades a edades más tempranas;
- Cáncer;
- Sobrepeso y obesidad (especialmente obesidad mórbida);
- Enfermedad renal crónica;
- Afecciones pulmonares crónicas como la enfermedad pulmonar obstructiva crónica, el asma, la enfermedad pulmonar intersticial, la fibrosis quística y la hipertensión pulmonar;
- Demencia y condiciones neurológicas relacionadas;
- Diabetes mellitus (tipos 1 y 2);
- Síndrome de Down;
- Condiciones cardíacas;
- Infección por VIH;
- Estado de inmunocompromiso;
- Enfermedad hepática;
- Embarazo;
- Anemia de células falciformes o talasemia;
- Fumar (actual y pasado);
- Pacientes que se han sometido a trasplantes de órganos o de células madre sanguíneas;
- Pacientes que han sufrido derrames cerebrales u otros tipos de infarto que reducen el suministro de sangre al cerebro;
- Trastornos por abuso de sustancias (alcoholismo, adicción a los opioides, adicción a la cocaína, etc.);
Las personas que padecen estas enfermedades y las que viven cerca de ellas deben extremar las precauciones, reforzar el aislamiento, la higiene y el uso de mascarillas, para reducir la probabilidad de infección al menor riesgo posible.
La preocupación por la infección de animales domésticos y salvajes tiene sentido, sobre todo si se tiene en cuenta que el SARS-CoV-2 se originó en especies de murciélagos asiáticos y “saltó” a la especie humana (en un proceso también conocido como spillover, en el que probablemente intervino un huésped intermedio). Sin embargo, teniendo en cuenta que el proceso de adaptación a una nueva especie es relativamente raro, siempre es importante basar preocupaciones como ésta en pruebas científicas y estudios que intenten determinar la probabilidad real de que el SARS-CoV-2 contamine a las mascotas.
Hasta ahora, la convivencia entre animales como perros y gatos y humanos en medio de la pandemia no parece ofrecer mayores riesgos para los implicados. Aunque hay casos en los que los perros y gatos domésticos dieron positivo al SARS-CoV-2, la transmisión del virus a estas especies no parece comprometer significativamente la salud de los animales, además de ocurrir aparentemente con una frecuencia menor que la transmisión de persona a persona: un artículo elaborado con la participación de investigadores de la Red Genómica de Fiocruz verificó la contaminación del virus en una proporción equivalente a 31 de cada 100 perros y 40 de cada 100 gatos que vivían en hogares con al menos un paciente humano con el nuevo coronavirus. En comparación, un estudio de los Centros para el Control de Enfermedades (CDC) de EE.UU. reveló que la enfermedad afecta a 53 de cada 100 personas que conviven con un paciente con la enfermedad. Una consideración adicional con respecto a las tasas de infección en perros y gatos es que el estudio citado se realizó con un número relativamente pequeño de animales, lo que limita un poco las posibles conclusiones sobre lo común que es la infección de estos animales por el nuevo coronavirus.
Independientemente de la exactitud de las tasas observadas en relación con el riesgo real, una de las recomendaciones del artículo que sigue siendo firme es que las familias que poseen perros y, especialmente, gatos, que parecen ser las de mayor riesgo, tomen la precaución de evitar el contacto estrecho entre los miembros de la familia con casos confirmados o sospechosos de COVID-19 y los animales, al igual que harían con otros miembros humanos de la familia. Es especialmente importante que no se permita a los animales dormir en la misma cama que los pacientes afectados por la enfermedad. Otra consideración importante es que los animales castrados parecen tener un riesgo ligeramente mayor que los no castrados.
La infección en el camino inverso, es decir, de las mascotas a los humanos sanos, no parece ocurrir. Por lo tanto, no hay razón, al menos por ahora, para temer el contagio de los gatos y perros que eventualmente presenten síntomas o den positivo en las pruebas del SARS-CoV-2.
Además de los gatos, otra de las especies domésticas más afectadas por el nuevo coronavirus son los visones, criados en granjas de varios países para su sacrificio y fabricación de productos como abrigos de piel y guantes. Sin embargo, como en Brasil no está permitida la cría de animales para la extracción de la piel, no se trata de un problema de salud colectiva.
La mejor manera de protegerse, hasta que la cobertura de vacunación alcance un porcentaje significativo de la población, es seguir las pautas de no fomentar las aglomeraciones (fiestas, barbacoas, reuniones familiares, etc.), salir de casa solo cuando sea necesario, y seguir las recomendaciones de uso de mascarillas e higiene de manos mejor explicadas en la respuesta a la pregunta “¿Cómo evitar el contagio y la propagación del nuevo coronavirus?”
En principio, las personas recién recuperadas de los síntomas de COVID-19 pueden seguir transmitiendo la enfermedad durante unos días. Aunque la duración varía de un individuo a otro -y posiblemente entre las variantes del virus-, las recomendaciones son que se observe un periodo de cuarentena antes de que los pacientes convalecientes puedan entrar en contacto con otros. Según el sitio web del Centro de Control de Enfermedades, los pacientes con síntomas leves deben esperar un mínimo de 10 días desde el inicio de los síntomas para conocer a otros. El periodo de 10 días también se recomienda para los pacientes asintomáticos que han dado positivo en las pruebas del virus. En estos casos, los 10 días se cuentan a partir de la fecha de la prueba. Para los pacientes graves o inmunodeprimidos, el periodo de cuarentena debe ser más largo, hasta 20 días.
Según una norma elaborada por el Hospital Universitario Walter Cândido, de la Universidad Federal de Ceará, las recomendaciones adicionales son que los pacientes que presenten síntomas -independientemente del estado de inmunosupresión- mantengan el aislamiento más allá de estos 10 o 20 días, hasta que presenten 24 horas sin fiebre y otros síntomas, en ausencia del uso de antipiréticos. Además, la norma recomienda que los pacientes recién trasplantados (tanto de médula ósea como de sólidos) o los que se preparan para recibir un trasplante con el uso de medicación inmunosupresora tengan una prueba RT-PCR no detectable después de 20 días desde el inicio de los síntomas para poder salir del aislamiento.
Es importante tener en cuenta que hay informes de eventos aislados en los que se han aislado partículas virales activas, incluso con capacidad replicativa, en pacientes al menos 18 días después del inicio de los síntomas.
Las variantes de un virus son el resultado de las mutaciones que se producen de forma natural durante el proceso de replicación, tanto en los virus como en los organismos vivos, como los seres humanos, otros animales, plantas y microorganismos. En una situación como la actual pandemia, en la que un virus se extiende por varias regiones geográficas, se espera que las nuevas mutaciones aparezcan de forma independiente en cada lugar. Cuando no se controla el movimiento de personas, estas variantes pueden seguir siendo transportadas y establecerse en otras regiones.
Las variantes, tanto en su lugar de origen como en las nuevas localizaciones alcanzadas, tienden a seguir sufriendo eventos de mutación y a ramificarse en nuevas entidades. Cuando una mutación confiere una ventaja evolutiva a las variantes que la portan, tiende a estabilizarse o a expandirse en la población, haciendo que estas variantes se vuelvan gradualmente más comunes que las que no tienen esta mutación. Este parece ser el caso de las mutaciones en la proteína S (implicada en la invasión de las células por el nuevo coronavirus) acumuladas por variantes como la P.1, que permiten escapar de la respuesta inmunitaria desarrollada tras una primera infección, permitiendo casos de reinfección por el virus. La mejor manera de prevenir la aparición de nuevas variantes es controlar la propagación de la enfermedad, ya que cada nuevo evento de infección es una ventana para la aparición de mutaciones. Por ello, lo ideal es realizar una campaña de vacunación para alcanzar una cobertura de vacunación satisfactoria (al menos el 70% de la población) lo antes posible, ya que una población parcialmente inmunizada puede favorecer la evolución del virus hacia variantes capaces de escapar a los mecanismos de defensa de la parte de la población inmune a la enfermedad.
La detección y el seguimiento de las variantes es todavía muy reciente, por lo que hay mucho que aprender sobre sus diferencias en términos clínicos. Hasta ahora, no se han encontrado nuevos síntomas asociados a las variantes conocidas. Sin embargo, se sabe que algunas de estas variantes -como la cepa Gama de Manaos (P.1), la cepa sudafricana Beta (B.1.351), la cepa británica Alpha (B.1.1.7) y la cepa india Delta (B.1.617.2)- son más transmisibles. Además, la cepa gamma se asocia con una mayor carga viral en los pacientes y porta mutaciones que le permiten escapar a la neutralización por parte de los anticuerpos (provocando la reinfección) y tener una mayor afinidad de unión al receptor celular humano, hACE2.
Mientras el virus siga en circulación, la acumulación de mutaciones es inevitable. Las denominadas cepas variantes son grupos de virus que comparten una o más mutaciones que los diferencian de las cepas “originales”, más parecidas a las del inicio de la pandemia.
Para organizar los datos generados en todo el mundo, la Organización Mundial de la Salud ha publicado una lista de variantes del nuevo coronavirus SARS-CoV-2 con mutaciones relevantes. Esta lista se actualiza constantemente y divide en tres categorías las variantes que requieren una vigilancia más prudente:
- Variantes de Interés (VOI, del inglés Variants of Interest): se trata de una clasificación muy sensible, para que no pasen desapercibidas las variantes con posibilidad de provocar el agravamiento del problema de salud. Unas pocas mutaciones en genes relevantes son suficientes para que una muestra se ajuste a este perfil. Para ser clasificada como VOI, una variante debe tener una mutación no silenciosa (que genere cambios en los aminoácidos) posiblemente asociada a cambios en la transmisibilidad, virulencia (capacidad de generar síntomas graves), epidemiología o en la capacidad de ser reconocida por el sistema inmunitario, además de haber causado múltiples casos de la enfermedad / transmisión comunitaria;
- Variantes Preocupantes (VOC, del inglés Variants of Concern): una VOI puede reclasificarse como VOC cuando, en un análisis comparativo con otras VOI, se demuestra que tiene una mayor transmisibilidad (o efectos negativos en la epidemiología del virus en la población), virulencia (presentación clínica más grave) o una menor eficacia de las medidas de salud pública (incluido el distanciamiento social y las opciones de diagnóstico, vacuna y tratamiento actualmente disponibles) contra la variante en cuestión.
- Variantes bajo Vigilancia (VUM, del inglés Variants under Monitoring) es una clasificación que se da a los perfiles genéticos mutantes del SARS-CoV-2 que no suponen necesariamente un riesgo, pero tienen características que justifican una vigilancia más cautelosa. La Organización Mundial de la Salud clasifica las cepas como VUM cuando se sospecha que algunas de sus alteraciones genéticas tienen efectos sobre las características virales potencialmente arriesgadas en el futuro, pero sin pruebas concluyentes sobre el mayor riesgo asociado a estas mutaciones según los conocimientos actuales.
Hasta ahora, la Red de Genómica y otros grupos de investigación de todo el mundo han descubierto que las mutaciones en los genes de la glicoproteína Spike (proteína S) del nuevo coronavirus SARS-CoV-2 se asocian a variantes con gran capacidad de convertirse en dominantes, como la P.1 (variante de Manaos), la B.1.1.7 (variante del Reino Unido) y la B.1.351 (variante de Sudáfrica). La existencia de alteraciones en diferentes regiones de la proteína S en estas muestras parece estar relacionada con una menor capacidad de neutralización por parte de los anticuerpos de los pacientes que ya han padecido la enfermedad (ya que estos anticuerpos se habrían generado para reconocer y neutralizar versiones de la proteína S de otras cepas, que no contenían estas alteraciones). Algunas mutaciones específicas han ido apareciendo de forma independiente en varios VOC y VOI, como las de las posiciones N501, E484, K417, N452 y T478 de la proteína Spike.
Se cree que la capacidad de circular tanto entre las personas que nunca han tenido contacto con el SARS-CoV-2 como entre las que ya han tenido la enfermedad (reinfecciones), unida a una mayor carga viral, es un factor importante para la dominancia observada para la variante P.1 en varias regiones de Brasil, según han descubierto los investigadores de la Red de Genómica de Fiocruz.
Las medidas de protección que deben observarse en relación con las nuevas variantes son las mismas que protegen de otros linajes del nuevo coronavirus, descritas en las respuestas a las preguntas “¿Cómo evitar la infección y la propagación del nuevo coronavirus?” y “En ausencia de un tratamiento y de una amplia vacunación, ¿cuál es la mejor manera de protegerme a mí y a mi familia?” anteriores.
Dado que se trata de una enfermedad nueva, aún quedan muchos aspectos por comprender sobre la COVID-19, y la relación de su causante con el sistema inmunitario humano sigue planteando muchos interrogantes a la comunidad científica. En principio, los mecanismos de inmunidad adquiridos tras una infección por el SARS-CoV-2 mantienen su función de prevención de nuevas infecciones durante al menos unos meses, por lo que es importante desarrollar vacunas que garanticen una mayor posibilidad de inmunidad a largo plazo.
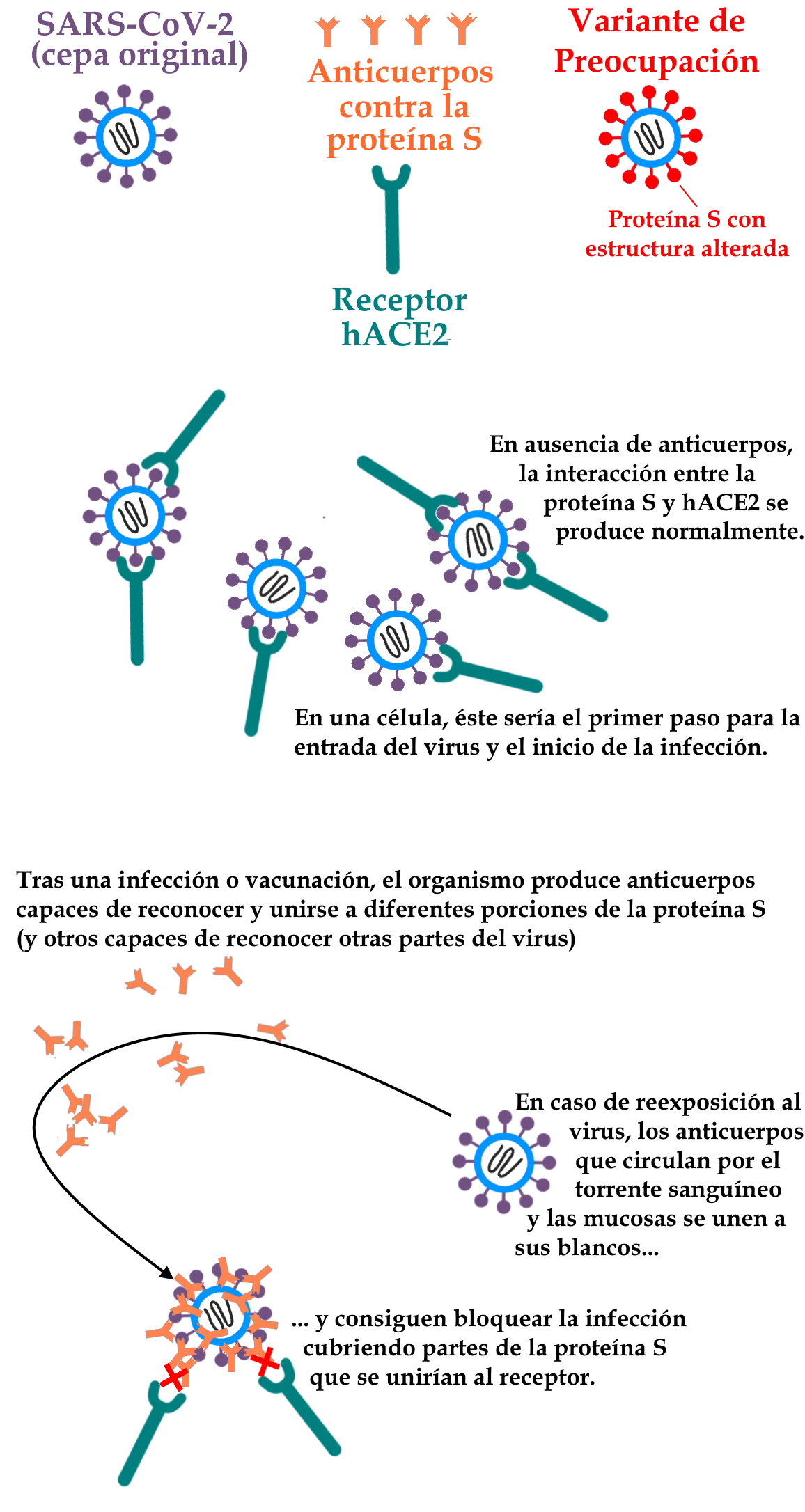
La aparición de variantes como la P.1, que llevan alteraciones relevantes en la glicoproteína Spike (proteína S, a través de la cual el virus es capaz de unirse a las células del huésped e invadirlas, causando la infección) fue responsable de varios casos comprobados de reinfección, ya que estas alteraciones disminuyen la acción de los anticuerpos sobre esta proteína. Se estima que el número real de reinfecciones es mucho mayor, debido a la dificultad técnica de probar estos casos. La menor eficacia de los anticuerpos contra estas mutaciones no puede evitar por completo que la proteína Spike de las variantes pueda unirse al receptor presente en las células humanas, provocando una nueva infección.
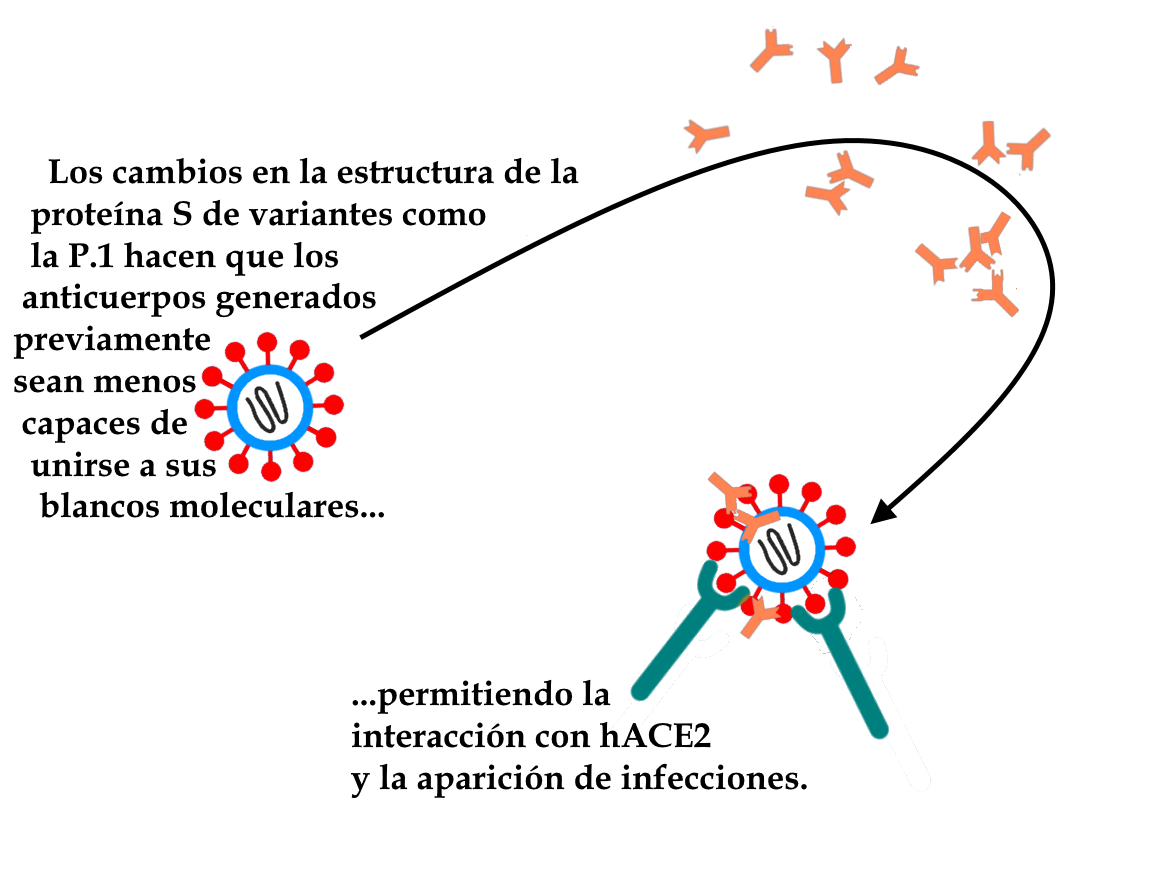
Hasta la fecha (marzo-2022), las pruebas apuntan a la capacidad de las vacunas utilizadas actualmente para generar anticuerpos capaces de neutralizar parcialmente el nuevo coronavirus, incluidas las variantes preocupantes que circulan en la actualidad, previniendo los casos graves de la enfermedad. Sin embargo, se ha demostrado que las variantes que preocupan son capaces de infectar incluso a personas vacunadas, aunque la inmunización tiende a proteger de las hospitalizaciones y las muertes.
Aunque, hasta la fecha, las vacunas son aparentemente capaces de proteger contra la infección grave por las nuevas variantes (véase la respuesta a la pregunta “¿Son inmunes a las variantes quienes han recibido la vacuna contra el coronavirus?” más arriba), la circulación desenfrenada del nuevo coronavirus en poblaciones parcialmente expuestas o parcialmente vacunadas favorece la aparición de más y más variantes de SARS-CoV-2. La posibilidad de que surjan variantes capaces de escapar por completo a la respuesta inmunitaria desencadenada por las vacunas es un riesgo que hay que tomar muy en serio, ya que este hecho podría suponer una prolongación de la pandemia.
Fiocruz trabaja en la lucha contra la pandemia de SARS-CoV-2 principalmente a través de la investigación en varios frentes de investigación. Las investigaciones desarrolladas por la Fundación en su conjunto van desde la comprensión del genoma y las características víricas hasta el estudio de la respuesta inmunitaria al virus, pasando por el ensayo de terapias y el desarrollo de inmunizadores, y muchas de ellas forman parte de programas de cooperación internacional en materia de investigación. A pesar de centrarse en la investigación científica, en Río de Janeiro, Fiocruz también ha construido un Centro Hospitalario para atender a los pacientes graves de COVID-19.
El trabajo de la Red Genómica de Fiocruz no implica la recolección directa de material, y los grupos de investigación no tienen personal de enfermería ni licencia para recolectar material. Todas las muestras utilizadas para la extracción y secuenciación del genoma son recogidas por profesionales de la salud, en Hospitales, Clínicas y Unidades Básicas de Salud y enviadas a los Laboratorios Centrales (Lacen) de cada Unidad Federativa. Es a través de la asociación con los Lacens que la Red Genómica de Fiocruz (y los institutos de investigación asociados) tiene acceso al estudio del genoma de estas muestras.
No. Como se explica en la respuesta a la pregunta “¿La Red de Genómica de Fiocruz realiza pruebas para diagnosticar si tengo el coronavirus e identificar por qué variantes?” arriba, la Red de Genómica de Fiocruz no realiza la recolección ni el procesamiento de las muestras ofrecidas directamente por los pacientes, y las muestras deben ser enviadas por las unidades de salud, los institutos de investigación biomédica y los lactarios de cada Unidad Federativa.
La elaboración y ensayo de vacunas no está entre los objetivos y atribuciones de investigación de la Red Genómica de Fiocruz. La Fundación Oswaldo Cruz es uno de los institutos de investigación biológica y biomédica más importantes del mundo, por lo que existen grupos y redes de investigación con experiencia en los más diversos temas. En el contexto de la nueva pandemia, estos laboratorios y redes de colaboración actúan en múltiples frentes para hacer frente al nuevo coronavirus, según la experiencia y los conocimientos técnicos de cada equipo. Estas investigaciones, aunque inicialmente se realicen de forma independiente y con enfoques distintos, pueden acabar informándose mutuamente.
Por ejemplo, aunque la Red Genómica no ha participado en ensayos clínicos de vacunas y no actúa en su producción, los estudios sobre las nuevas variantes y los mecanismos que permiten que escapen a la respuesta inmunitaria son importantes para controlar los efectos de la vacunación. Estos estudios también pueden informar, en el futuro, sobre la necesidad y
los objetivos para el desarrollo de nuevas vacunas, que se ofrecerán a la población en los años siguientes o si aparecen variantes capaces de escapar completamente al efecto protector de los inmunizantes actuales.
El origen exacto del SARS-CoV-2 aún no se ha dilucidado y el tema sigue siendo objeto de investigación. Hay pruebas sólidas que apuntan a un origen animal. Las comparaciones entre el genoma del virus obtenido de los pacientes y otros coronavirus revelan una proximidad con el RatG13, que se encuentra en los murciélagos, y que probablemente infectó primero a un huésped intermedio y acabó saltando a los humanos en entornos en los que hay un estrecho contacto entre especies, como los mercados de animales o las cuevas. Además, no hay ningún rastro en la estructura genómica del SARS-CoV-2 de manipulación del material genético del virus. Esta hipótesis ha sido verificada por diferentes grupos de investigación de todo el mundo, que no han encontrado pruebas que la respalden.
Sobre todo, teniendo en cuenta que el genoma del SARS-CoV-2 es muy parecido al de otros coronavirus, como el SARS-CoV y el MERS-CoV, ambos virus de origen natural que han provocado brotes de poca importancia en diversos momentos de la historia reciente de la humanidad, la idea de que el nuevo coronavirus proceda de un laboratorio -y no de los mismos procesos naturales que generaron estos “parientes”- parece poco probable.

